近年來,腺相關病毒 (AAV) 作為基因和細胞治療載體的使用顯著增加。因此,概念驗證和臨床試驗期間所需的 AAV 載體數量也有所增加。AAV 血清型 6 (AAV6) 因其在轉導不同細胞類型方面的效率而得到充分證明,并已成功用于基因和細胞治療方案。然而,據估計,將轉基因有效遞送至單個細胞所需的載體數量為 10^6 VG (病毒基因組)。總體而言,這意味著需要大規模生產 AAV6。基于懸浮細胞的平臺目前僅限于低細胞密度生產,阻礙了該生產工藝提高產量的潛力。在這里,我們研究了在更高細胞密度下,提高 AAV6 產量的方案。通過瞬時轉染 HEK293SF 細胞進行生產。當以細胞為基礎提供質粒 DNA 時,可以在中等細胞密度下進行生產,而不會影響細胞特異性滴度或顆粒功能,從而使滴度高于 10^10 VG/mL。就 VG/cell而言,在高細胞密度生產中,培養基添加減輕了細胞密度效應。另一方面,細胞特異性功能滴度沒有得到維持,需要進一步研究以了解觀察到的局限性。此處報告的中等細胞密度生產方法為大規模工藝操作奠定了基礎,有可能解決當前 AAV 生產中的載體短缺問題。
腺相關病毒 (AAV) 是一種小的、25 nm寬、二十面體、無囊膜的病毒,具有 4.7 kb長的單鏈 DNA 基因組,屬于細小病毒科。AAV 是非致病性和復制缺陷型,這取決于與輔助病毒(如腺病毒或單純皰疹病毒)的共同感染。AAV 于 1960 年代首次從腺病毒庫中發現,最近已成為治療疾病的關鍵基因遞送載體。Glybera 是歐洲藥品管理局于 2012 年批準的第一個基于 AAV 的基因治療藥物。美國食品和藥物管理局 (FDA) 于 2017 年批準了基于 AAV 的基因治療藥物 Luxturna,并于 2019 年批準了 Zolgesma。
迄今為止,基于系統發育分析,已鑒定出 13 種不同的血清型和 100 多種 AAV 變體。由于衣殼蛋白的異質性,每種血清型都表現出不同的趨向性以及轉導不同細胞類型的能力。血清型 6 具有廣泛的靶細胞,已顯示可成功轉導中樞神經系統、人前列腺癌、乳腺癌和肝癌細胞、黑素細胞、骨骼肌、心臟、肺和眼部的細胞。最近,AAV6 因其轉導淋巴細胞的能力及其用于生成嵌合抗原受體 T 細胞的用途而受到歡迎。
行業正在研究的治療性 AAV 應用的數量正在穩步增加,有超過 300 項已完成或正在進行的臨床試驗。這些應用需要大量 AAV 載體來驗證臨床前動物研究和臨床試驗。報告的靶向給藥劑量最高可達 7.5 x 10^15 VG,全身給藥最高可達 1.5 x 10^17 VG。這種對病毒載體數量的巨大需求意味著有必要改進當前的生產方法。對于 AAV 血清型 6 尤其如此,它在 T 細胞轉導期間需要高達 10^6 VG/cell。重組 AAV 是通過用目的基因 (GOI) 替換病毒基因 Rep 和 Cap 而產生的。哺乳動物細胞瞬時轉染一個 GOI 盒,GOI 盒兩側是反向末端重復序列,一個攜帶 Rep 和 Cap 功能的質粒,以及編碼輔助功能的第三個質粒。瞬時轉染通常使用具有成本效益的陽離子聚合物 - 聚乙烯亞胺 (PEI) 完成。然而,對于超過 10^15 VG 的 AAV 生產規模,貼壁細胞培養被認為是不可行的,這使得它們不適合這些病毒載體的后期臨床試驗和商業應用。2006 年有研究首次描述了使用懸浮 HEK293 細胞生產 AAV 載體的方案。盡管在優化生產方面做出了許多努力,但 AAV 載體的大規模生產被認為是其作為基因治療和細胞治療的病毒載體而實施的瓶頸,主要是因為目前基于 HEK293 的生產是在低細胞密度條件下完成的。將病毒載體的生產限制在低細胞密度條件下,阻礙了這種生產工藝得到強化的潛力。另一方面,在較高細胞密度下生產病毒載體往往會受到廣泛報道的細胞密度效應 (CDE) 的限制,這會導致轉染和生產力下降。在本研究中,我們證明了通過瞬時轉染生產 AAV 血清型 6 且不局限于低細胞密度培養的方案。
詳細試驗操作和結果,請參考原文。
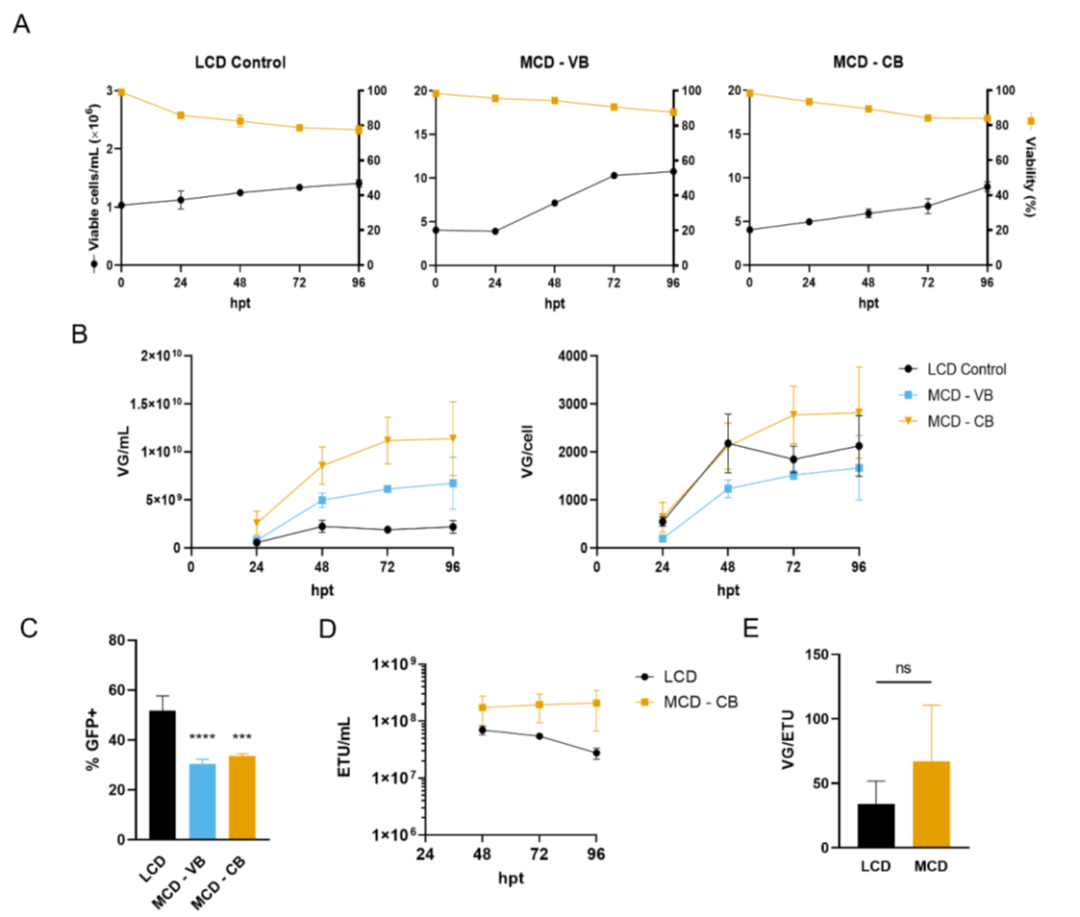
圖2. 在中等細胞密度條件下,通過三質粒轉染,生產AAV6。
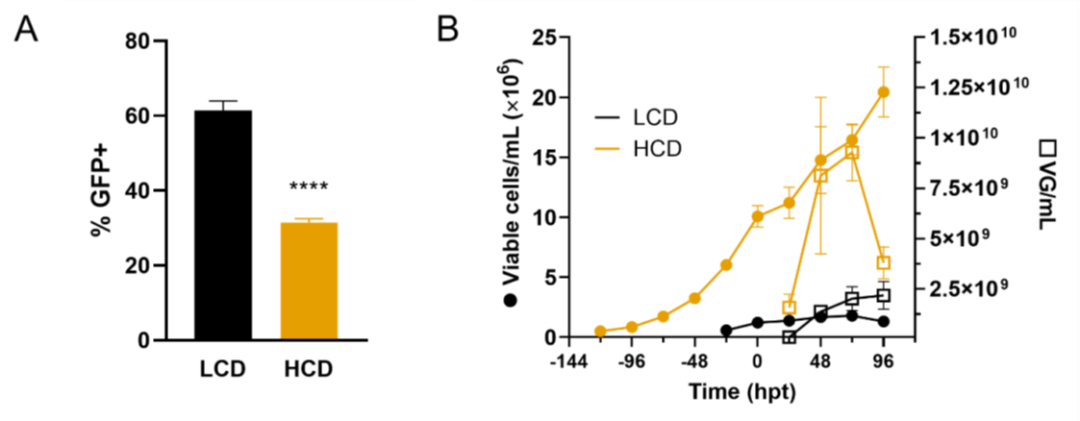
圖3. 在高細胞密度條件下,通過三質粒轉染,生產AAV6。
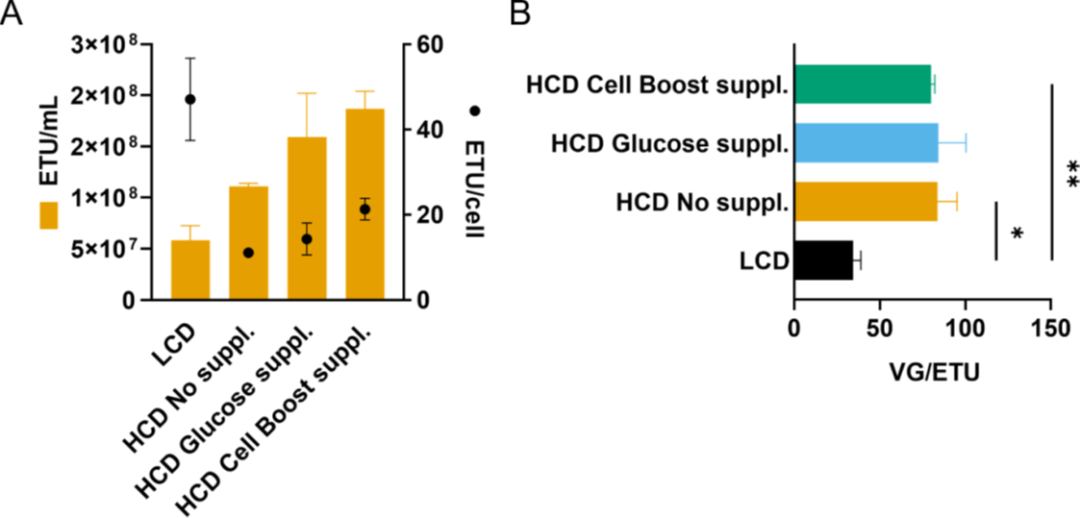
圖6. 在不同細胞密度條件下,AAV6的生產。
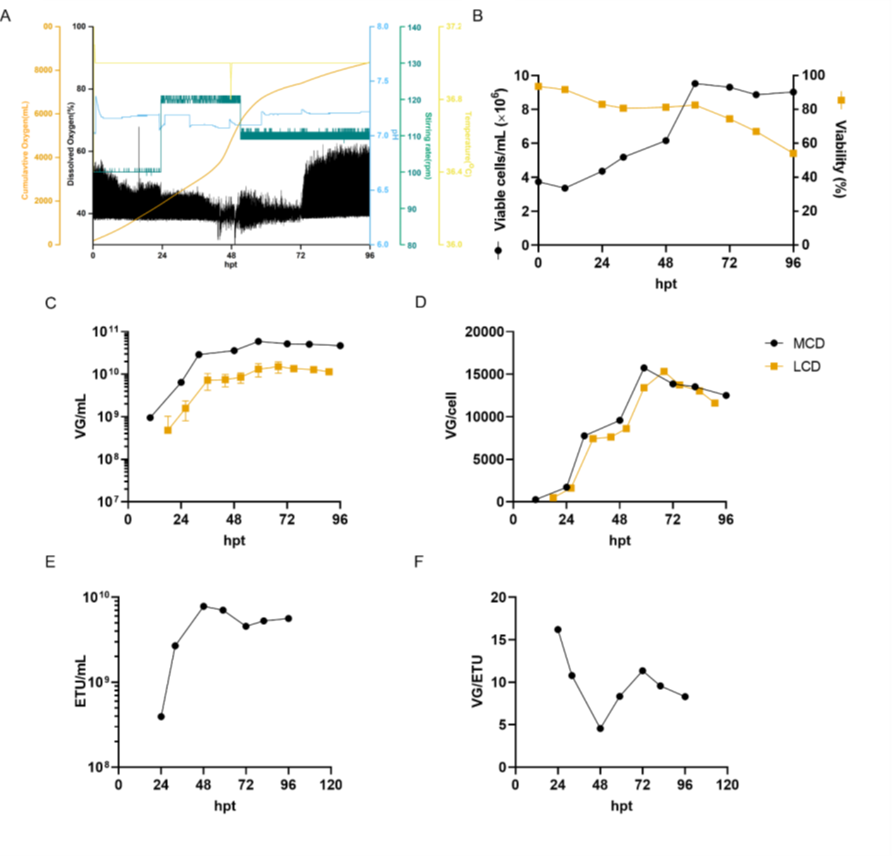
圖7. 在中等細胞密度下,AAV6的生物反應器生產。
討論
在圖 1 中,我們觀察到當轉染時的細胞密度從 1 增加到 2 x 106 cell/mL時,質粒 DNA 可用性在維持 VG 滴度方面起著重要作用。在低細胞密度瞬時轉染中,質粒 DNA 通常以體積為基礎進行遞送。與我們的研究一樣。Grieger、Soltys 和 Samulski 也觀察到當細胞密度和質粒濃度加倍時,生產過程中的滴度增加。對于 4 x 106 cells/mL(中等細胞密度,MCD)的生產,還觀察到需要更高的質粒 DNA 濃度。轉染時細胞數量增加 4 倍導致病毒滴度 (VG/mL) 幾乎呈線性增加(圖 2B)。此外,在 MCD 生產過程中保持了細胞特異性生產率,質粒 DNA 濃度保持在每個細胞的基礎上(圖 2B)。獲得了 1,500 至 3,000 VG/cell的產率,與 Chahal、Schulze、Tran、Montes 和 Kamen 報道的產率相似。還觀察到功能性顆粒 (ETU) 滴度的提高。以細胞為基礎遞送質粒 DNA 的 MCD 生產的功能性滴度保持不變(圖 2D),與 96 hpt 的 LCD 對照相比,差異高達 3.9 倍。在 LCD 上,轉導單元略有減少,但含有基因組的顆粒沒有減少,這可以用病毒載體功能的喪失來解釋。AAV 載體是熱穩定性的,但當維持在 37°C 且 pH 值降低時,它們的轉導效率會降低。由于氨和乳酸等代謝物的積累,將培養延長至 96 hpt 可降低細胞內和細胞外 pH 值。
VG/ETU 比率衡量病毒功能,顯示能夠轉導靶細胞的含有基因組的病毒的比例。在 48 hpt 時,MCD 生產的平均 VG/ETU 比率為 67.1(圖 2E)。盡管該值高于文獻中報道的值,但與我們的 LCD 對照組沒有統計學上的顯著差異。如圖 7 所示,中等細胞密度的 AAV6 生產在 3 L 生物反應器中成功進行。將細胞以 4 x 10^6 cells/mL 的所需細胞密度接種到含有新鮮培養基的生物反應器中,以防止耗竭的培養基產生不利影響。在更大規模上,這可以通過使用切向流深層過濾 (TFDF) 等作為細胞截留裝置的培養基置換策略來實現。與之前報道的類似規模化生產相比,這種生物反應器生產分別導致 VG/mL 和 VG/cell滴度增加 30 倍和 7.5 倍。令人驚訝的是,生物反應器上的病毒載體產率比小規模衛星培養高約 10 倍。同樣,LCD 生物反應器生產也顯示出比小規模實驗更高的產率。生物反應器中產率的提高可能與更好地調節培養條件有關,例如溶氧和 pH 值。同樣,沒有觀察到功能性滴度的損失,轉染后 48 小時達到最大值 7.8 x 10^9 ETU/mL,VG/ETU 比率為 4.6(圖 7D 和 E)。這些結果表明比以前的報告有所改進。
當生產在 1 x 10^6 cells/mL 以外的細胞密度下進行時,轉染效率(通過轉染后 24 小時的轉基因表達測量)降低至約 30%,不同細胞密度的情況相似(圖 1B、圖 2C、和圖 3A)。然而,表達轉基因的細胞百分比與生產效率沒有直接關聯。其他研究小組在通過瞬時轉染 HEK293SF 懸浮細胞產生病毒樣顆粒的工藝中也觀察到了同樣的現象。Hildinger、Baldi、Stettler 和 Wurm 得出結論,轉染效率的降低是由基于體積的 DNA 供應造成的。然而,在我們的研究中增加質粒 DNA 可用性并沒有顯著提高轉導效率(圖 1B、圖 2C 和圖 3A),這是通過檢測三種質粒之一的產物來衡量的,這證實了之前的發現。據報道,能量需求增加會發生在較高的細胞密度下,并允許從轉染中恢復,這是一種已知具有細胞毒性的事件。在類似灌流模式的生產工藝中,轉染效率沒有提高,即使補充了培養基(圖 5B)也是如此。在較高的葡萄糖濃度下轉染效率甚至更低。Lavado-García、Jorge、Cervera、Vázquez 和 Godia 部分解釋了低轉染效率是由于參與脂質生物合成和細胞內蛋白質核轉運的途徑下調所致。轉染步驟本身是 AAV 載體生產中的一個已知瓶頸。我們小組最近的一項研究表明,盡管轉導效率很高,但產生病毒顆粒的細胞比例低至 7%。
最近,報道了采用培養基置換策略在高細胞密度下提高 AAV8 產量。相反,細胞密度效應在我們的高細胞密度生產工藝中得到證實(圖 3B 和 5)。 CDE 是指在高細胞密度下由于細胞特異性生產力降低而導致的產量下降。先前已經記錄了使用其它生產系統(例如昆蟲細胞)生產 AAV 時的這種效果。在生產過程中,25% 到 30% 的 AVV6 載體會釋放到上清液中。由于高細胞密度以及提高振蕩速度以適當為生物反應器供氧,因此細胞可能處于增加的純應力下,并且可能已將更多載體釋放到上清液中,這些載體在培養基置換期間被去除。這可以解釋在 HCD 生產中病毒滴度在 96 hpt 時突然下降(圖 3B),這是意料之外的,因為 AAV 載體被認為在很寬的溫度范圍內非常穩定。然而,同樣的下降,補充培養基時未觀察到 (圖 5C)。
細胞密度效應被認為主要是由于低濃度營養物或抑制性代謝物積累引起的代謝限制所致。在 HCD 的生產工藝中,采用了類似灌流的模式來提供足夠的營養,以支持高細胞密度并去除抑制性代謝物;然而,所選擇的條件不足以防止 CDE(圖 3)。盡管每天完全置換培養基,但在 HCD 時葡萄糖水平顯著下降。出于這個原因,基礎培養基 HyCell TransFx-H 含有約 6 g/L 的葡萄糖,并添加了葡萄糖或 Cells Boost 5。添加的量取決于細胞特異性葡萄糖消耗率,因此在任何給定時間都至少有 2 g/L 的葡萄糖可用,模仿在 LCD 產品中觀察到的葡萄糖濃度。單獨添加葡萄糖的培養基并不能恢復 AAV6 的細胞特異性生產力(圖 5C)。CDE 得到緩解,并且僅當使用補充有 15% Cell Boost 5 的培養基時才能恢復細胞特異性生產力(VG/cell)(圖 5C),這表明其它關鍵營養素限制了病毒載體生產。除了葡萄糖,Cell Boost 5 添加物的其它成分被認為有助于緩解 CDE。在使用 HEK293SF 細胞生產腺病毒載體時,Shen、Voyer、Tom 和 Kamen 強調所用培養基的組成對于支持 HCD 的高產率至關重要。然而,培養基和添加物的復雜性,例如 Cell Boost 5,它可以包含數百種不同濃度的不同成分,使對單個營養素對病毒載體生產的影響的理解變得復雜。優化細胞培養基,可以在生產AAV 載體時,提高滴度和載體質量,正如其它病毒載體中所見和所建議的那樣。
如上所述,在培養基中添加 Cell Boost 5 可在含基因組顆粒方面減輕對細胞密度的影響;然而,對于功能性顆粒卻沒有觀察到同樣的情況。雖然補充培養基后功能性產量有所增加,但細胞特異性功能滴度(ETU/cell)并未完全保持,導致與 LCD 對照相比更高的 VG/ETU 比率(圖 6)。一種可能的解釋是病毒衣殼的錯誤組裝,其化學計量比為 1:1:10 (VP1:VP2:VP3)。如果這個比例發生改變,AAV 遞送轉基因的功效就會降低。由于核定位信號,VP1 和 VP2 蛋白在轉導中起著至關重要的作用,特別是在核轉運中。VP1 的 N 末端還包含一個磷脂酶 A2 結構域,負責病毒從核內體中逃逸。我們的結果強調了通過測量生物活性載體評估病毒轉導功效的重要性,作為優化 AAV 載體生產的一部分。盡管病毒載體的質量屬性(包括功能滴度)是 FDA 推薦的效力測試的重要組成部分,但研究人員有時會忽略這種測量。
總之,我們證明可以在中等細胞密度下通過三質粒瞬時轉染產生 AAV6,而不會損失細胞特異性生產力或功能滴度。為此,必須以細胞為基礎提供質粒 DNA。我們的中等細胞密度產品達到了 10^10 VG/mL 粗裂解液滴度。與完善的生產方案相比,通過這種方法獲得的產量顯著增加。本研究中描述的用于 AAV 載體生產的中等細胞密度方法被證明在 3 L 生物反應器規模上是有效的。它可以用作大規模生產工藝的基礎,可能有助于解決當前 AAV 生產中的載體短缺問題。當使用補充培養基進行類似灌流的操作時,細胞密度效應可以在更高的細胞密度下得到緩解,從而導致相似的細胞特異性生產率(VG/cell)。然而,細胞特異性功能生產率(ETU/cell)減少,突出了在生物工藝優化過程中評估病毒基因組和轉導單元的重要性。需要進一步研究,以充分了解細胞密度效應如何導致功能滴度降低,以及如何完全緩解這種現象。
原文:P. Moco, X. Xu, A. Kamen, High-cell-density production of adeno-associated viral vector serotype 6 by triple transfection in suspension HEK293 cell cultures. 2023.






