目前,我們對(duì)人體免疫系統(tǒng)的認(rèn)識(shí)仍然存在片面性,比如許多具有臨床重要性的免疫受體已被視為“孤兒”,它們的配體仍未被發(fā)現(xiàn);又比如我們的研究方法仍局限于單個(gè)受體,缺乏系統(tǒng)地表征整個(gè)細(xì)胞表面蛋白質(zhì)組的吞吐量,諸如此類(lèi)的問(wèn)題。我們都知道,人體免疫系統(tǒng)由分布在全身循環(huán)的細(xì)胞網(wǎng)絡(luò)組成,這就迫切地需要產(chǎn)生真正系統(tǒng)級(jí)的免疫細(xì)胞功能全方位互作視圖。2022年8月3日,Nature發(fā)布了一項(xiàng)最新研究,劍橋大學(xué)、約克大學(xué)
前言ADC藥物是一類(lèi)極具潛力的抗腫瘤藥物,正處于快速發(fā)展中,雖已有14個(gè)ADC正式獲批,但ADC結(jié)構(gòu)復(fù)雜,開(kāi)發(fā)和優(yōu)化新的ADC藥物仍是一項(xiàng)不小的挑戰(zhàn)。研究ADC藥物的“構(gòu)效關(guān)系”、了解ADC藥物療效/安全性與ADC改造之間的內(nèi)在聯(lián)系,將有利于指導(dǎo)和加速ADC藥物開(kāi)發(fā)。作者 | betaloc腫瘤相關(guān)抗原HER2在近30%的乳腺癌及部分實(shí)體瘤中高表達(dá),是重要的腫瘤藥物開(kāi)發(fā)靶點(diǎn)。HER2單抗trast
以下文章來(lái)源于生物制藥小編 ,作者清風(fēng)Linker-drug (LD) 與抗體的偶聯(lián)是產(chǎn)生ADC和確定ADC關(guān)鍵質(zhì)量屬性的關(guān)鍵步驟,其可以從根本上改變ADC的藥代動(dòng)力學(xué)和治療指數(shù)。目前超過(guò)95%的ADC基于兩種偶聯(lián)技術(shù):半胱氨酸烷基化或賴(lài)氨酸酰化。前十個(gè)獲批的ADC中有7個(gè)基于半胱氨酸偶聯(lián)(Adcetris、Polivy、Padcev、Enhertu、Trodelvy、Blenrep和ZynLon
來(lái)源:藥渡撰文:木下土 編輯:丸子1前言基于藥物的溶解度和滲透性因素形成了生物藥劑學(xué)分類(lèi)系統(tǒng)(BCS),這套系統(tǒng)目前已經(jīng)成為世界上比較公認(rèn)的影響藥物的劑型設(shè)計(jì)和預(yù)測(cè)藥物體內(nèi)-體外相關(guān)性的重要指標(biāo),同時(shí)也指出了藥物在胃腸道中的溶解性和滲透性是決定藥物吸收程度的關(guān)鍵。藥物的腸道滲透性是指其跨腸壁細(xì)胞進(jìn)入血液循環(huán)的能力,通常以單位時(shí)間或單位面積進(jìn)入的藥量來(lái)衡量。高滲透性有利于藥物跨細(xì)胞膜,到達(dá)作用
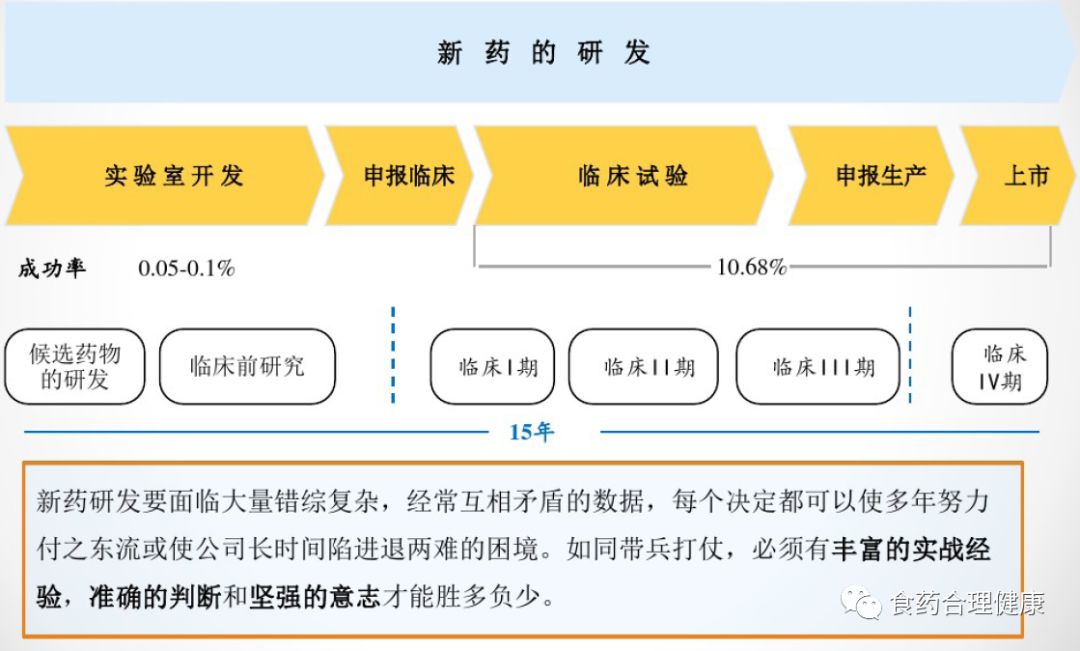
新藥研發(fā)及發(fā)現(xiàn)新化合物并推進(jìn)成功上市的過(guò)程新藥生命周期中涉及到國(guó)家相關(guān)法規(guī)新藥的實(shí)驗(yàn)室研發(fā)流程——候選藥物的研發(fā)新藥實(shí)驗(yàn)室開(kāi)發(fā)流程——臨床前研究新藥臨床試驗(yàn)申請(qǐng)流程新藥臨床試驗(yàn)流程新藥注冊(cè)申報(bào)流程仿制藥研發(fā)流程仿制藥生物等效性研發(fā)流程仿制藥申報(bào)生產(chǎn)流程新藥物研發(fā)是醫(yī)藥公司運(yùn)轉(zhuǎn)的齒輪,推動(dòng)公司發(fā)展,所以開(kāi)展新藥研發(fā),了解整個(gè)新藥研發(fā)流程是醫(yī)藥公司生存的命脈新藥研發(fā)也是一項(xiàng)投資高、風(fēng)險(xiǎn)高、周期長(zhǎng)、競(jìng)爭(zhēng)
轉(zhuǎn)自小藥說(shuō)藥前言以細(xì)胞為基礎(chǔ)的治療,包括將細(xì)胞作為活性藥物來(lái)治療疾病,近年來(lái)在臨床應(yīng)用和醫(yī)藥市場(chǎng)的擴(kuò)張方面都經(jīng)歷了爆炸性增長(zhǎng)。特別是,一些療法已經(jīng)進(jìn)入了商業(yè)應(yīng)用,2017年FDA批準(zhǔn)tisagenlecleucel和Axicabatagene ciloleucel分別用于治療急性淋巴細(xì)胞白血病(ALL)和大B細(xì)胞淋巴瘤(LBCL)。最近的其他成功包括批準(zhǔn)使用患者來(lái)源的角膜緣干細(xì)胞修復(fù)受損的角膜上皮

您可以在此處留言您想要和我們說(shuō)的話,我們會(huì)仔細(xì)查看的哦。
在此輸入您的留言內(nèi)容
